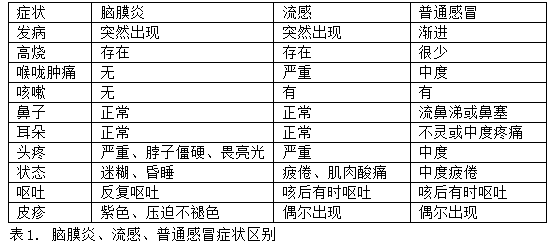
主题:诺华制药的B型脑膜炎奈瑟菌疫苗bexsero(已经被GSK收购)香港什么时候上市?
正序浏览
主题图片汇总
主题内检索
相关标签:
普林斯顿
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
1 帖
浏览:427 回帖:8
第 1 页 / 共 1 页
游客没有回帖权限
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
9 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
8 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
7 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
6 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
5 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
4 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
3 帖
(0)
(0)
只看该作者
不看该作者
加入黑名单
举报
返回顶部
个人图文集
个人作品集
第
2 帖
回复主题: 诺华制药的B型脑膜炎奈瑟菌疫苗bexsero(已经被GSK收购)香港什么时候上市?
功能受限
游客无回复权限,请登录后再试